Diabetická nefropatia – chronická choroba obličiek pri diabetes mellitus: diagnostika, prevencia a liečba
Autoři:
Adrián Okša 1; Zbynek Schroner 2; Katarína Rašlová 2; Emil Martinka 2; Vladimír Uličiansky 2
Působiště autorů:
Slovenská nefrologická spoločnosť
1; Slovenská diabetologická spoločnosť
2
Vyšlo v časopise:
Diab Obez 2021; 64(Supplementum): 5-13
Kategorie:
Odporúčané postupy SNefS a SDS
Odporúčané postupy Slovenskej nefrologickej spoločnosti a Slovenskej diabetologickej spoločnosti – UPDATE 2021
1 Úvod
Chronická choroba obličiek (Chronic Kidney Disease – CKD) je podobne ako diabetes mellitus celosvetovým zdravotníckym problémom. Jej výskyt narastá do epidemických rozmerov v rozvinutom aj rozvojovom svete. Na základe všeobecne akceptovanej klasifikácie CKD podľa KDIGO – Kidney Disease Improving Global Outcomes (tab. 1) sa jej prevalencia v rôznych krajinách odhaduje na 9–13 %, t. j. asi 850 miliónov ľudí. Pacienti s terminálnym zlyhaním obličiek, resp. dialyzovaní tvoria len nepatrnú časť populácie (< 0,1 %), no vzhľadom na finančnú náročnosť zdravotnej starostlivosti v tomto štádiu CKD spotrebúvajú rádovo väčší podiel zo zdravotníckych rozpočtov vo vyspelých krajinách. Väčšina chorých sa nachádza v prvých 3 štádiách s normálnou až stredne zníženou glomerulovou filtráciou (GF), ale práve tieto štádiá CKD zostávajú často nediagnostikované, čo prispieva k progresii choroby až do zlyhania obličiek. V Európe, USA a vo väčšine krajín sveta je v súčasnosti diabetes mellitus najčastejšou príčinou terminálneho zlyhania obličiek s podielom okolo 40 %. Navyše predstavuje CKD, rovnako ako diabetes, významný faktor kardiovaskulárneho (KV) rizika a kombinácia oboch rapídne zhoršuje celkovú prognózu pacienta.
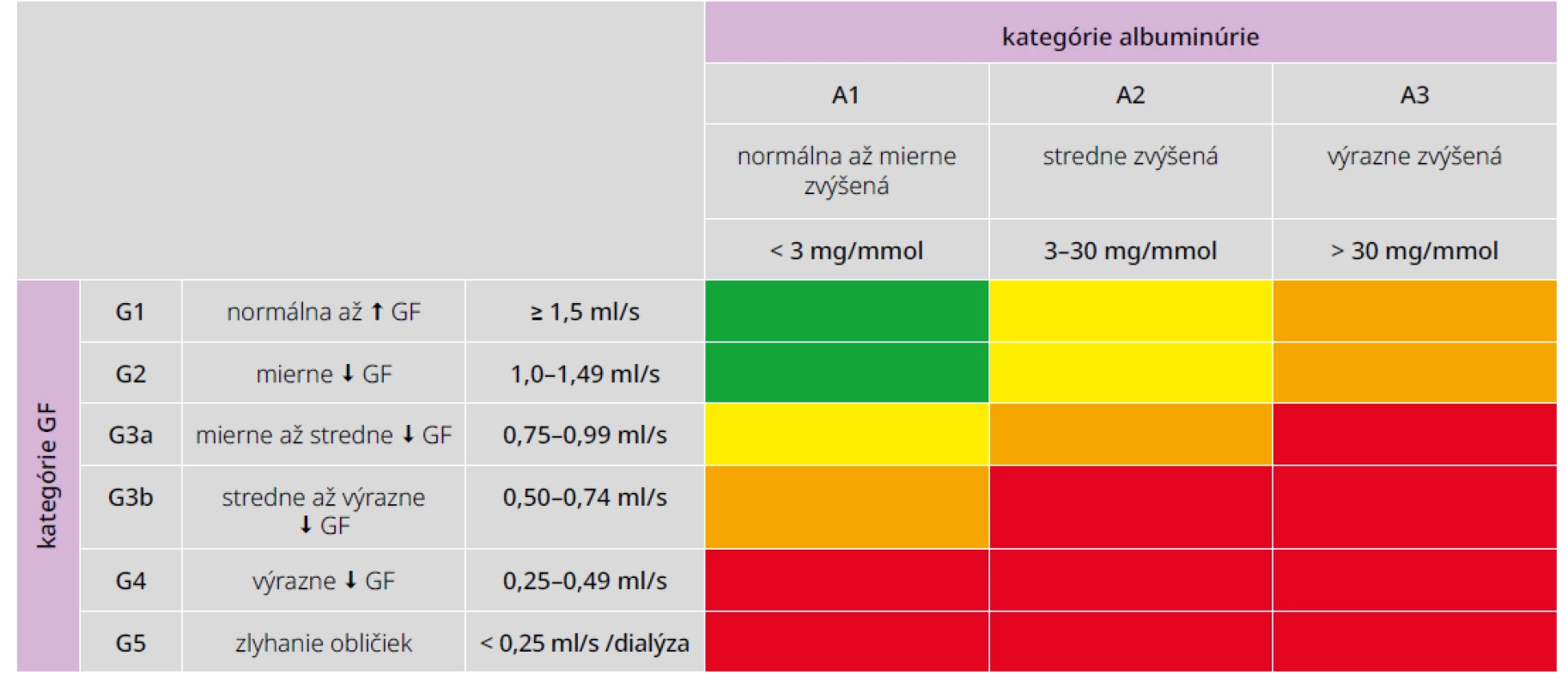
Kategória A2 zodpovedá mikroalbuminúrii, A3 makroalbuminúrii (klinickej proteinúrii), hodnoty v tabuľke vyjadrujú pomer koncentrácie albumínu
a kreatinínu v jednorazovom moči.
Na označenie štádia CKD sa kombinujú kategórie GF a albuminúrie, napr. G1A1, G3aA2 a pod.
Farba políčok vyjadruje riziko progresie nefropatie od nízkeho (zelená) cez zvýšené (žltá), vysoké (oranžová) až po veľmi vysoké (červená).
2 Epidemiológia
Epidemiologické údaje o diabetickej nefropatii (DN) sú spoľahlivejšie u diabetikov 1. typu, u ktorých je možné presnejšie stanoviť trvanie diabetu. V tejto skupine bývala prevalencia DN (bez ohľadu na jej štádium) 30–40 % po 15–20 rokoch trvania diabetu. Novšie štúdie z viacerých európskych krajín uvádzajú podstatne nižší výskyt manifestnej DN (< 10 %) ako aj progresie do zlyhania obličiek (< 3 %) pravdepodobne v súvislosti s lepšou kontrolou glykémie a krvného tlaku. U diabetikov 2. typu existujú v prevalencii DN veľké etnické rozdiely, ale v Európe je v súčasnosti renálne riziko porovnateľné s diabetom 1. typu. Štatistické údaje komplikuje aj nejednotná terminológia: v niektorých krajinách sa novšie používa pojem diabetická choroba obličiek (Diabetic Kidney Disease – DKD), ktorý má širší význam a zahŕňa aj štruktúrne a funkčné zmeny v obličkách spôsobené komorbiditami (ateroskleróza, esenciálna hypertenzia, chronické srdcové zlyhávanie, obezita, recidivujúce pyelonefritídy, refluxová nefropatia pri neurogénnom močovom mechúri a iné). Nové odporúčania KDIGO 2020 uprednostňujú pojem CKD pri diabetes mellitus.
Podľa štatistickej ročenky NCZI malo u nás v roku 2019 „obličkové komplikácie“ 12,8 % všetkých diabetikov a zlyhanie obličiek na podklade DN 33,6 % pacientov v pravidelnej dialyzačnej liečbe. Podľa výsledkov slovenskej štúdie CARERA malo v súbore viac ako 5 600 ambulantných pacientov s diabetom 2. typu odhadovanú GF < 1 ml/s 14,1 % a zvýšenú albuminúriu 31,3 % chorých. V podobnej epidemiologickej štúdii NEFRITI bola v roku 2014 odhadovaná GF < 1 ml/s u 17,3 % diabetikov 2. typu a v roku 2018 u 20,4 % pacientov.
3 Patogenéza
Diabetická nefropatia je závažná chronická mikrovaskulárna komplikácia diabetes mellitus. Pre vznik DN je rozhodujúce diabetické prostredie s chronickou hyperglykémiou, ktorá spôsobuje zmeny v štruktúre a funkcii všetkých súčastí filtračnej bariéry – endotelu, glomerulovej bazálnej membrány (GBM) a podocytov, ako aj mezangia a tubulárnych buniek. Na tomto procese sa podieľajú viaceré mechanizmy: neenzýmová glykácia proteínov s tvorbou produktov pokročilej glykácie (Advanced Glycation Endproducts – AGEs), polyolová cesta metabolizmu glukózy, zvýšená aktivita intrarenálneho renín-angiotenzínového systému (RAS), zvýšená produkcia rastových faktorov a cytokínov s prozápalovými a proliferatívnymi účinkami v mezangiu, endotelová dysfunkcia, znížený obsah fyziologických glykozaminoglykanov v GBM, znížená expresia nefrínu a iných proteínov filtračnej bariéry produkovaných podocytmi a iné. Súčasne sa od skorého štádia vývoja DN uplatňujú hemodynamické zmeny so zvýšenou perfúziou glomerulov, intraglomerulovou hypertenziou a hyperfiltráciou, ktoré potencujú vývoj glomerulosklerózy a sekundárnej tubulointersticiálnej fibrózy. Pre účasť genetických faktorov na patogenéze DN svedčí jej častejší výskyt v rodinách pacientov pri oboch typoch diabetu: identifikoval sa možný podiel génových polymorfizmov viacerých zložiek RAS, aldózoreduktázy, proteínkinázy C a iných.
Diabetická nefropatia nemá špecifický morfologický obraz. V prvých štádiách sa pozoruje zhrubnutie GBM, neskôr expanzia mezangia s hromadením extracelulárnej hmoty a rozvojom glomerulosklerózy (typická je nodulárna, ale častejšia difúzna forma), ktorá vedie postupne k oklúzii kapilárnych slučiek a zániku glomerulov. V pokročilom štádiu DN býva prítomná hyalinóza arteriol, atrofia tubulov a fibróza interstícia.
4 Diagnostika
Perzistentná mikroalbuminúria je zvyčajne prvým klinickým prejavom DN pri diabete 1. typu (DM1T) a markerom vzniku DN pri diabete 2. typu (DM2T). Typický vývoj DN pri DM1T podľa Mogensena je zhrnutý v tab. 2. Takýto priebeh môže byť dnes významne modifikovaný modernou antihyperglykemickou liečbou, ako aj štandardným používaním inhibítorov RAS: oba postupy znižujú albuminúriu/proteinúriu a spomaľujú pokles GF (podrobnejšie v časti 5, s. 8).
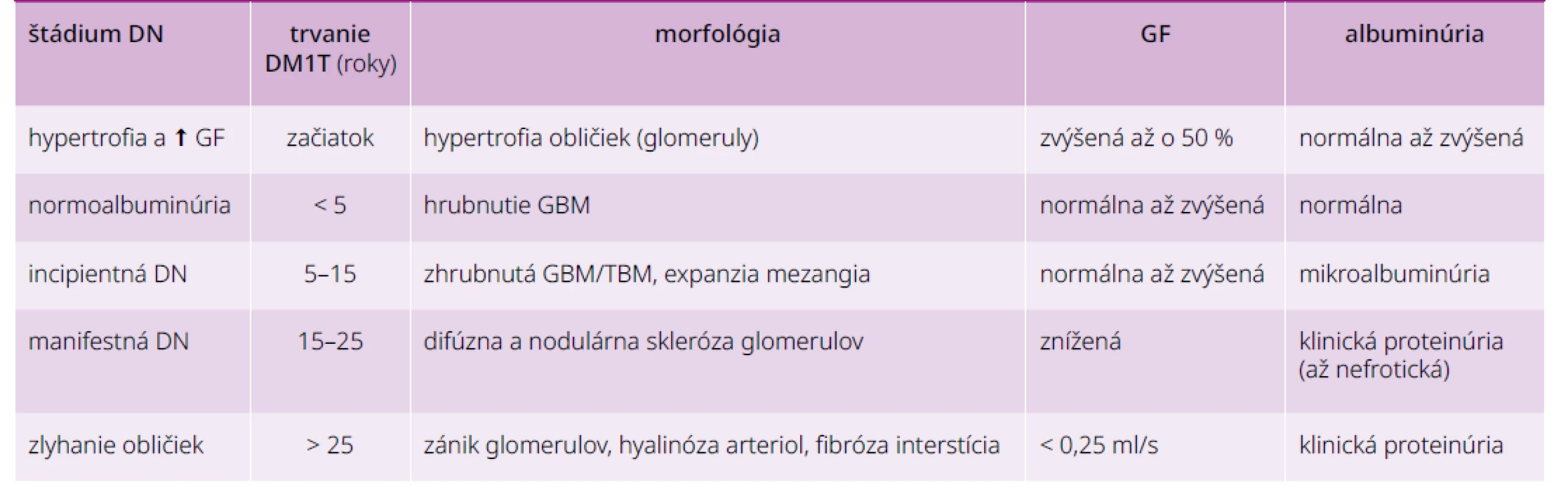
Kým pri DM1T existuje pomerne dobrá korelácia medzi trvaním diabetu, histopatologickým nálezom v obličkách a stupňom albuminúrie či poklesom GF (štádiá DN podľa Mogensena), situácia pri DM2T je odlišná: v bioptických štúdiách u pacientov s DM2T s mikroalbuminúriou malo asi 40 % zmeny typické pre DN, 30 % normálny nález a 30 % nediabetické zmeny. Priebeh DN je pri DM2T ovplyvnený vyšším vekom a komorbiditami (ateroskleróza, esenciálna hypertenzia, chronické srdcové zlyhávanie, obezita a iné). U časti diabetikov 1. aj 2. typu sa poškodenie obličiek prejavuje najskôr poklesom GF bez prítomnosti mikroalbuminúrie, preto skríning DN má zahŕňať aj výpočet GF. Diferenciálna diagnostika nefropatie u diabetika je zhrnutá v časti 4.2 (s. 8).
4.1 Skríning
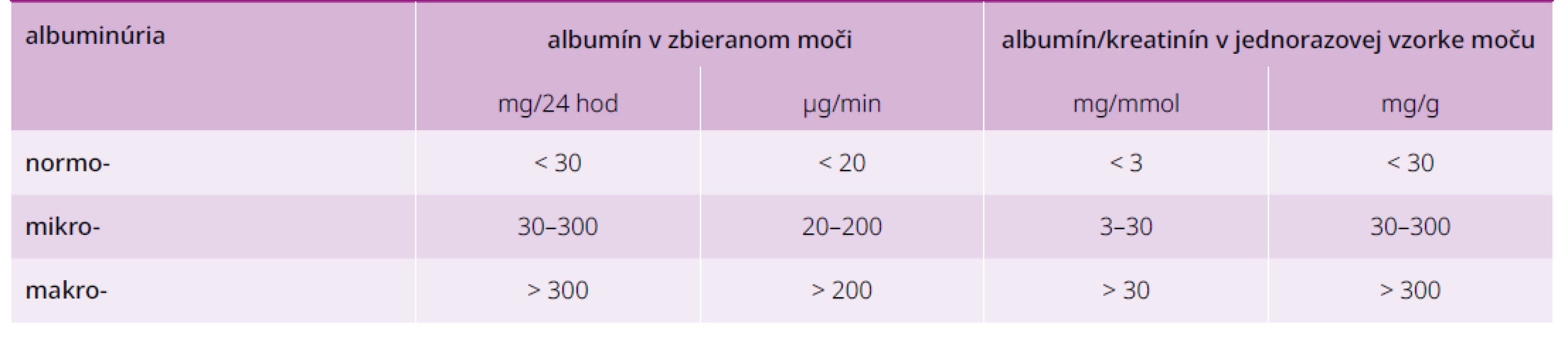
Skríning DN vykonáva spravidla diabetológ alebo detský endokrinológ a diabetológ v rámci špecializovanej ambulantnej zdravotnej starostlivosti. Skríning DN zahŕňa vyšetrenie albuminúrie a výpočet GF. Oba parametre by sa mali stanovovať najmenej raz do roka, a to po 5 rokoch trvania DM1T a od určenia diagnózy DM2T. Diagnostické kritériá DN pri rôznych spôsoboch stanovenia albuminúrie sú uvedenév tab. 3. Vyšetrenie pomeru koncentrácie albumínu a kreatinínu v náhodnej (väčšinou rannej) vzorke moču má dostatočnú senzitivitu a špecifickosť v porovnaní so zbernými metódami (> 85 %) a odstraňuje ich nevýhody. Pre možnosť spontánnej alebo liečbou navodenej regresie vyžaduje nález mikroalbuminúrie potvrdenie aspoň v 2 vzorkách z 3 odobratých v rozmedzí 3–6 mesiacov. Súčasne je potrebné vylúčenie interferencie (falošnej pozitivity) najčastejšie pri fyzickej záťaži, (uro)infekcii, horúčke, výraznej hyperglykémii, hypertenzii a srdcovom zlyhávaní.
Na výpočet GF sa dnes preferujú rovnice CKD EPI alebo MDRD4, ktoré okrem koncentrácie sérového kreatinínu zohľadňujú vek, pohlavie a rasu:
GF CKD EPI [ml/s/1,73 m2] = 141 × min (Krs /κ, 1)α × max (Krs /κ, 1)-1,209 × 0,993vek × (1,018 u žien) × (1,159 u afroameričanov)
Krs – kreatinín v sére (µmol/l) κ – je 61,9 u žien a 79,6 u mužov α – je -0,329 u žien a -0,411 u mužov, min – minimum pomeru Krs /κ alebo 1 max – maximum pomeru Krs /κ alebo 1
GF MDRD4 [ml/s/1,73 m2] = 547,1535* × Krs -1,154 [µmol/l] × vek-0,203 × (0,742 u žien) × (1,21 u afroameričanov)
*pri medzinárodne štandardizovanej metóde stanovenia Krs má koeficient hodnotu 515,3832
Výpočet GF má svoje úskalia, o ktorých musí najmä nefrológ vedieť: nezohľadňuje faktory ovplyvňujúce koncentráciu kreatinínu v sére, ako je podiel živočíšnych bielkovín v strave, výživové doplnky s obsahom kreatínu (metabolizuje sa na kreatinín), svalová záťaž (kreatín ’ kreatinín), zmeny v tubulárnej sekrécii kreatinínu, lieky (fibráty!), extrarenálny clearance kreatinínu a pod. Výpočet väčšinou nadhodnocuje skutočnú GF, a to tým viac, čím je vyššia a nedá sa použiť pri náhlych zmenách GF. Tieto poznatky treba vziať do úvahy pri diagnostike a klasifikácii štádia DN.
Ďalšie metódy výpočtu GF sa v súčasnosti overujú. Najviac prebádaný je v tomto smere endogénny marker cystatín C, ktorého koncentrácia v sére síce oveľa menej závisí od svalovej hmoty, ale tiež nie je konštantná: zvyšuje sa napr. u starých ľudí, diabetikov, obéznych, fajčiarov, pri zápalových chorobách a iných. Rovnice na odhad GF založené na cystatíne C preto neboli doteraz presnejšie ako CKD EPI, určité zlepšenie priniesla len kombinácia oboch markerov v jednej rovnici. Nevýhodou cystatínu C zostáva jeho cena a nedostatočná štandardizácia.
Starší spôsob výpočtu clearance kreatinínu podľa Cockcrofta a Gaulta je menej presný (najmä pri oboch krajných hodnotách GF, u obéznych a starších ľudí). Samotný sérový kreatinín je veľmi hrubým ukazovateľom renálnych funkcií a nemal by sa v diagnostike CKD používať bez súčasného výpočtu GF, ktorý umožňuje aj určenie štádia nefropatie (tab. 1). Kalkulácia GF by sa mala stať bežnou súčasťou vyšetrenia kreatinínu v každom biochemickom laboratóriu.
4.2 Diferenciálna diagnostika
U väčšiny diabetikov s CKD sa dá predpokladať jej diabetický pôvod, ak je prítomná:
- makroalbuminúria (klinická či manifestná proteinúria) alebo
- mikroalbuminúria spolu s diabetickou retinopatiou, resp. mikroalbuminúria pri DM1T trvajúcom najmenej 10 rokov
V ostatných prípadoch treba starostlivo zvážiť aj možnosť nediabetickej nefropatie, ktorá vyžaduje odlišný terapeutický postup. V diferenciálnej diagnostike pomáha, ak sa súčasne berie do úvahy nielen stupeň albuminúrie, ale aj GF (štádium CKD), tab. 4.
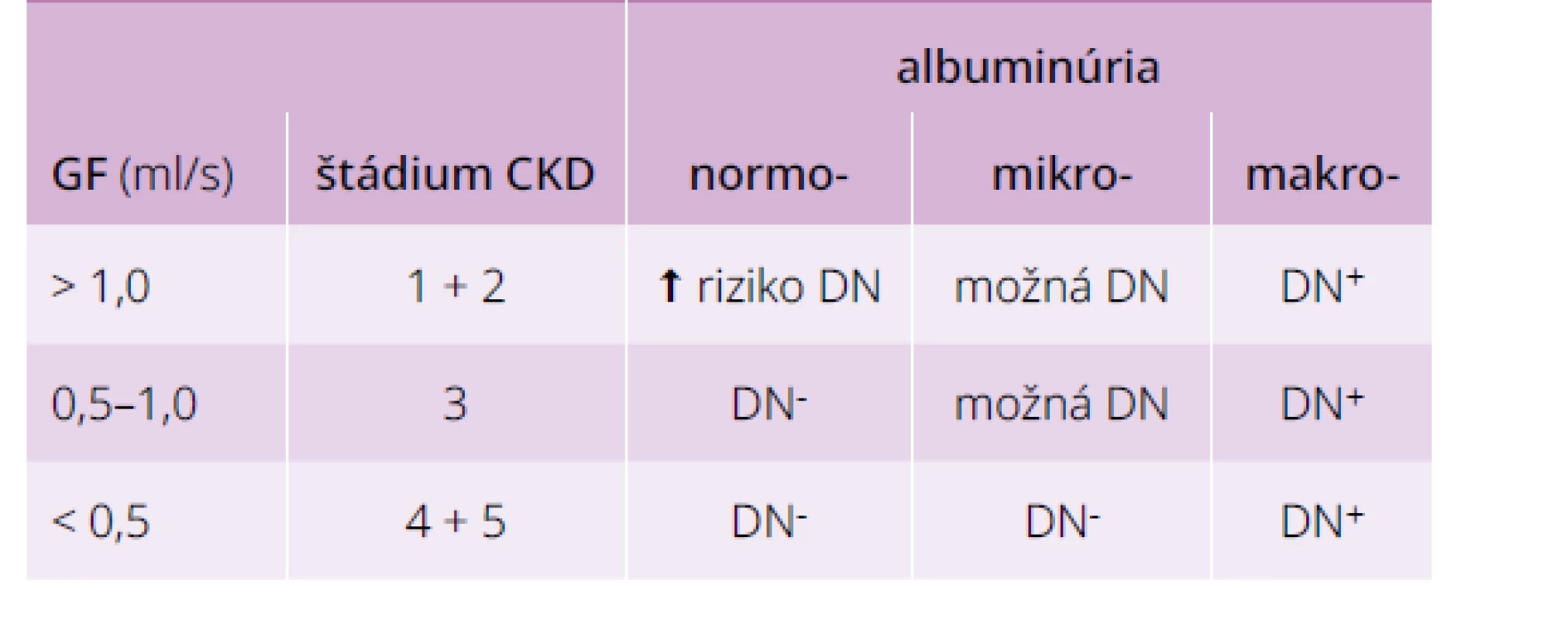
Typické a dokonca aj pokročilé diabetické zmeny na glomeruloch sa dajú nájsť u časti pacientov s normálnou alebo mierne zníženou GF (CKD 1–2). Na začiatku rozvoja DN totiž obličky hyperfiltrujú a nález tzv. normálnej GF môže znamenať už významnú stratu funkcie. Preto majú aj títo pacienti zvýšené riziko DN, najmä ak sú prítomné ďalšie rizikové faktory ako nedostatočná kontrola glykémie, dlhšie trvanie diabetu, hypertenzia, retinopatia, tzv. vyššia normálna albuminúria, iná než biela rasa a rodinná anamnéza DM2T, DN, hypertenzie, či kardiovaskulárnych chorôb. Ďalší pokles GF < 1 ml/s pri normoalbuminúrii síce prítomnosť DN nevylučuje, ale pravdepodobnejšie sú nediabetické zmeny podobne ako pri výraznom znížení GF (CKD 4–5) s mikroalbuminúriou. Diferenciálno-diagnostické úvahy komplikuje aj fakt, že liečba blokátormi RAS môže spôsobiť posun od makro - do mikroalbuminúrie, resp. od mikro - do normoalbuminúrie.
Čiastočnú pomoc pri diferenciálnej diagnostike nefropatie u diabetika predstavuje nález diabetickej retinopatie. Senzitivita a špecifickosť retinopatie ako markera DN sa významne líši podľa stupňa albuminúrie. Pri mikroalbuminúrii je vysoká predovšetkým negatívna prediktívna hodnota (takmer 100 %), t. j. absencia retinopatie svedčí s vysokou pravdepodobnosťou proti DN. Pri makroalbuminúrii je naopak vyššia pozitívna prediktívna hodnota, t. j. prítomnosť retinopatie poukazuje s vysokou pravdepodobnosťou na DN.
Okolnosti, pri ktorých treba u diabetika myslieť na nediabetickú nefropatiu, možno zhrnúť nasledovne:
- chýbanie diabetickej retinopatie (najmä u pacientov s DM2T s mikroalbuminúriou)
- nízka GF s normo - a mikroalbuminúriou
- rýchly pokles GF
- rýchly nárast proteinúrie
- rezistentná hypertenzia
- pokles GF > 30 % behom 1–2 mesiacov po začatí liečby blokátormi RAS alebo zvýšení dávky
- príznaky inej systémovej choroby
V odôvodnených prípadoch je indikovaná renálna biopsia.
5 Prevencia a liečba
V prevencii a liečbe DN, resp. CKD pri diabete majú zásadný význam diétne a režimové opatrenia, kontrola glykémie, liečba hypertenzie a dyslipoproteinémie.
5.1 Diétne a režimové opatrenia
Prítomnosť CKD stavia diabetika pred náročnú úlohu modifikovať doterajšiu diabetickú diétu, a to predovšetkým znížením príjmu bielkovín. Podľa KDIGO 2020 má byť strava individualizovaná s dostatkom zeleniny, ovocia (cave! pokročilá CKD s rizikom hyperkaliémie), celozrnných obilnín, vlákniny, strukovín, rastlinných bielkovín, nenasýtených tukov a orechov, a naopak s obmedzením spracovaného mäsa, rafinovaných sacharidov a sladených nápojov. V otázke nízkobielkovinovej diéty sú odporúčania KDIGO pomerne liberálne s obmedzením na 0,8 g/kg váhy/deň u všetkých diabetikov s CKD s výnimkou dialyzovaných, u ktorých má byť príjem bielkovín 1,0–1,2 g/kg/deň. Nie sú jednoznačné dôkazy z randomizovaných kontrolovaných štúdií, resp. ich metaanalýz (málo štúdií, nízky počet účastníkov, krátke trvanie), že diéta s ešte nižším obsahom bielkovín (< 0,6 g/kg/deň) spomaľuje progresiu CKD u diabetikov a podobne nie je ani možné odporučiť rôzny príjem bielkovín pre rôzne štádiá CKD. Diéta s veľmi nízkym obsahom bielkovín zvyšuje riziko proteínovo-energetickej malnutrície, a to viac práve u diabetikov.
Podrobnejšie nutričné odporúčania KDOQI 2020 pripúšťajú u diabetikov s CKD 3–5 (okrem dialyzovaných) redukciu príjmu bielkovín na 0,6–0,8 g/kg váhy/deň (pri slabej úrovni dôkazov – „opinion“). Tento postup sa odlišuje od diéty u metabolicky stabilných pacientov s CKD 3–5 bez diabetu, kde je možná ešte väčšia reštrikcia bielkovín (< 0,6 g/kg/deň), ev. v kombinácii s ketoanalógmi aminokyselín v dostatočnej dávke na spomalenie progresie nefropatie. Nie sú dostatočné dôkazy pre odporúčanie určitého typu proteínov (rastlinné vs živočíšne) vo vzťahu k ich efektu na celkový stav nutrície, metabolizmus minerálov alebo lipidov. V prevencii proteínovo-energetickej malnutrície sa u metabolicky stabilných pacientov s CKD 1–5 (vrátane dialyzovaných a transplantovaných) odporúča dostatočný energetický príjem 25–35 kcal/kg váhy/deň so zohľadnením veku, pohlavia, fyzickej aktivity, cieľovej hmotnosti, štádia CKD a komorbidít.
V ideálnom prípade lekár pri edukácii, motivácii a kontrole diétnych opatrení spolupracuje s diétnou sestrou, resp. nutričným terapeutom. Podrobnejší opis diéty vrátane výživových doplnkov a mikronutrientov je nad rámec tejto publikácie.
U pacientov s diabetom a CKD je vhodná pravidelná fyzická aktivita strednej intenzity (metabolický ekvivalent 3–6, t. j. rýchla chôdza, bicyklovanie, jóga, plávanie) v rozsahu aspoň 150 minút/týždeň s ohľadom na vek a komorbidity.
Fajčenie (aktívne aj pasívne) zvyšuje kardiovaskulárne aj renálne riziko, preto by pacienti s diabetom a CKD nemali fajčiť. O vplyve elektronických cigariet v tejto populácii zatiaľ nie je dosť informácií.
5.2 Kontrola glykémie
Randomizované kontrolované štúdie ukázali, že zníženie koncentrácie HbA1c < 7 % pri intenzifikovanom inzulínovom režime spomaľuje rozvoj mikroalbuminúrie, resp. jej progresiu do makroalbuminúrie u oboch typov diabetu. Slabšie sú dôkazy o tom, že takýto postup spomaľuje aj pokles GF (väčšinou malé súbory pacientov s nižšou štatistickou silou). Spoločným nedostatkom uvedených štúdií je, že zahrnuli len málo pacientov s pokročilejšou CKD v štádiu 3–5. U týchto diabetikov (najmä DM1T) je riziko hypoglykémie pri intenzifikovanej liečbe niekoľkonásobne vyššie pre znížený clearance inzulínu, ako aj zníženú glukoneogenézu v obličkách. S poklesom GF sa znižuje aj eliminácia niektorých perorálnych antidiabetík alebo ich aktívnych metabolitov obličkami. Prehľad použiteľnosti jednotlivých antidiabetík a inzulínov pri zníženej GF uvádza tab. 5, s. 11.
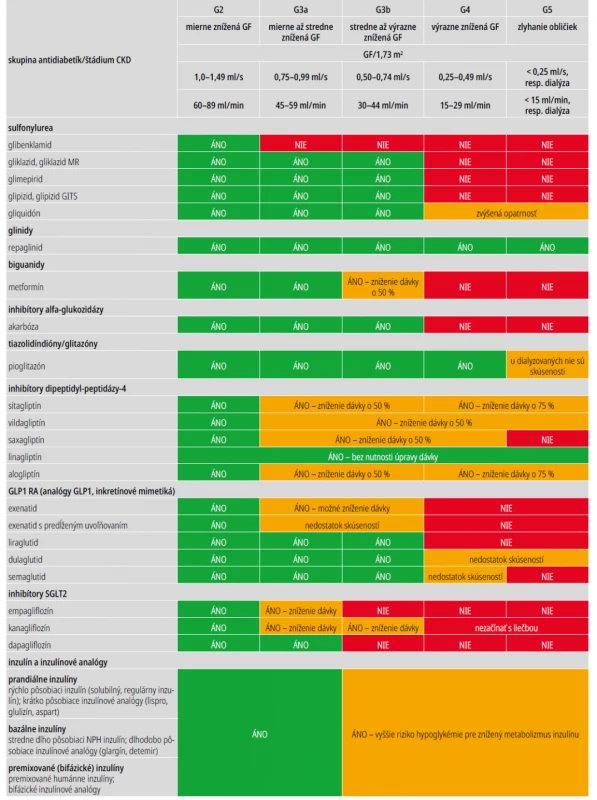
Aj u diabetikov s CKD je HbA1c preferovaným markerom glykemickej kontroly, ale cieľové hodnoty majú byť individualizované na < 6,5–8 % podľa závažnosti CKD, makrovaskulárnych komplikácií, komorbidít, veku a rizika hypoglykémie. Hodnoty HbA1c môžu by zvýšené pri zápale, oxidačnom strese, metabolickej acidóze, karbamylácii hemoglobínu, a naopak znížené pri anémii, liečbe železom, erytropoetínmi alebo krvnými transfúziami. Spoľahlivosť HbA1c ako markera glykemickej kontroly je pri pokročilej CKD 4–5 a najmä u pacientov na dialýze nízka, preto sa u nich odporúča skôr kontinuálne monitorovanie glykémie, alebo aspoň častý self-monitoring.
Liekom prvej voľby u diabetikov 2. typu s CKD a GF ≥ 0,5 ml/s je metformín ako účinný, bezpečný a lacný antidiabetický preparát. Pre jeho renálnu elimináciu treba dávku metformínu redukovať pri GF < 0,75 ml/s o polovicu (u niektorých pacientov už pri GF < 1,0 ml/s) a pri GF < 0,5 ml/s už nepodávať pre zvýšené riziko nežiaducich účinkov. U pacientov na dlhodobej liečbe metformínom (> 4 roky), resp. ohrozených deficitom vitamínu B12 je vhodné monitorovať koncentráciu vitamínu B12 v sére.
Podľa súčasných odporúčaní ADA a EASD sú u pacientov s CKD a GF ≥ 0,5 ml/s alebo albuminúriou (najmä makroalbuminúriou) liekmi druhej voľby inhibítory kotransportéra pre sodík a glukózu typu 2 (SGLT2i), a to aj nezávisle od východiskových či cieľových hodnôt HbA1c. Tieto lieky preukázali signifikantný renoprotektívny účinok (spomalenie poklesu GF a zníženie albuminúrie), ako aj kardioprotektívne pôsobenie v štúdiách zameraných na primárne renálne (CREDENCE – kanagliflozín, DAPA-CKD – dapagliflozín), resp. KV-cieľové ukazovatele (EMPA-REG OUTCOME – empagliflozín, CANVAS – kanagliflozín, DECLARE-TIMI 58 – dapagliflozín). Podľa KDIGO 2020 je pre väčšinu diabetikov 2. typu s CKD a GF ≥ 0,5 ml/s vhodná už iniciálna kombinácia metformínu a SGLT2i (v nižších dávkach), ktorá vhodne dopĺňa efekt metformínu na zníženie HbA1c o orgánovú protekciu SGLT2i (nezávislú od HbA1c) a má nízke riziko hypoglykémie. Úprava dávkovania SGLT2i podľa súčasných indikačných obmedzení platných v SR je uvedená v tab. 5.
Pri intolerancii alebo kontraindikácii SGLT2i, resp. pri nedostatočnom efekte na cieľové hodnoty HbA1c sa odporúčajú agonisty receptora pre GLP1 (GLP1 RA), ktoré v štúdiách zameraných na primárne KV-cieľové ukazovatele preukázali potenciálny renoprotektívny efekt (zníženie rizika kombinovaného renálneho cieľového ukazovateľa a albuminúrie, nie však spomalenie poklesu GF). Výber ostatných antidiabetických prípravkov a ich kombinácií by sa mal riadiť úrovňou GF, komorbiditami, preferenciou pacienta a indikačnými obmedzeniami.
Aj u diabetikov na hemodialýze alebo peritoneálnej dialýze má dobrá glykemická kompenzácia význam pre spomalenie progresie ostatných mikro - a makrovaskulárnych komplikácií a dokázateľne zlepšuje prežívanie pacientov.
5.3 Liečba hypertenzie
Liečba hypertenzie u diabetikov s CKD má byť individualizovaná s ohľadom na vek, komorbidity a inú farmakoterapiu. Podľa odporúčaní ESC/EASD 2019 má byť cieľový krvný tlak (TK) < 130/80 mm Hg (bez ohľadu na výšku albuminúrie), ale dlhodobo nie < 120/70 mm Hg. U starších chorých (> 65 rokov) môžu byť cieľové hodnoty systolického krvného tlaku vyššie (< 140 mm Hg); je potrebné ich dosahovať postupne s častým monitorovaním možných vedľajších účinkov liečby (ortostatická hypotenzia, elektrolytová dysbalancia, akútne poškodenie obličiek).
Nové odporúčania KDIGO 2021 na liečbu hypertenzie u pacientov s CKD posúvajú hodnoty cieľového systolického TK < 120 mm Hg (bez ohľadu na prítomnosť diabetu, okrem dialyzovaných a transplantovaných) s veľkým dôrazom na štandardizované meranie TK v ambulancii a dobrú toleranciu zo strany pacienta. Štandardizované meranie TK na rozdiel od rutinného zahŕňa adekvátnu prípravu pacienta, validovaný a periodicky kalibrovaný tlakomer a správnu techniku merania (podrobnosti sú nad rámec tejto publikácie). V individuálnych prípadoch môže byť doplnené ambulantným alebo domácim monitorovaním TK. Skupina expertov KDIGO vychádzala najmä zo záverov štúdie SPRINT a metaanalýz, ktoré ukázali, že zníženie systolického TK < 120 mm Hg v porovnaní s hodnotami < 140 mm Hg je spojené s poklesom KV-morbidity a mortality (ale nie s renoprotektívnym účinkom!) u väčšiny pacientov s CKD. Dôkazy sú však menej zrejmé u diabetikov pri CKD v štádiu 4–5 alebo proteinúrii > 1 g/deň. U pacientov po transplantácii obličky zostáva doterajšie odporúčanie cieľového TK < 130/80 mm Hg pri štandardizovanom meraní.
Liekmi voľby sú u pacientov v štádiu CKD 1–4 s albuminúriou (kategórie A2, A3) inhibítory angiotenzín konvertujúceho enzýmu (ACEI) alebo blokátory angiotenzínových receptorov (ARB), ktoré znižujú albuminúriu a spomaľujú progresiu nefropatie viac ako iné antihypertenzíva (renoprotektívny efekt nezávislý od zníženia krvného tlaku). U pacientov bez albuminúrie (A1) sa účinok ACEI alebo ARB na progresiu CKD (primárna prevencia) zatiaľ jednoznačne nepotvrdil. Blokátory RAS sa majú použiť v maximálnych tolerovaných dávkach. Duálna blokáda ACEI a ARB sa neodporúča pre vysoké riziko akútneho poškodenia obličiek a hyperkaliémie, a to najmä u pacientov s vysokým KV-rizikom. Podobne riziková môže byť kombinácia ACEI alebo ARB s inhibítorom renínu aliskirenom, resp. s antagonistami aldosterónu najmä vo vyšších štádiách CKD. Odporúča sa kontrola TK, sérového kreatinínu a kália behom 2–4 týždňov po začatí liečby ACEI/ARB alebo po zvýšení ich dávky: prechodné zvýšenie sérového kreatinínu do 30 % nie je dôvodom na prerušenie liečby. Pri hyperkaliémii (DM2T ako rizikový faktor!) je potrebné uprednostniť opatrenia na zníženie kaliémie pred ukončením liečby ACEI/ARB (strava, iné lieky, podanie diuretík, bikarbonát pri metabolickej acidóze, ionomeniče). Nie je jasné, či sa má liečba ACEI/ARB ukončiť pri progresii do CKD 5 s cieľom oddialiť nástup dialýzy.
U väčšiny chorých sa dá cieľový TK dosiahnuť len kombináciou antihypertenzív. Najúčinnejšia je kombinácia ACEI alebo ARB s diuretikom, ktoré efekt blokátorov RAS potencuje, bráni hyperkaliémii a retencii sodíka a vody. V malých dávkach a najmä v kombinácii s blokátormi RAS nie sú nepriaznivé metabolické účinky diuretík významné. Vhodná je aj úvodná kombinácia s blokátormi kalciových kanálov: dihydropyridínové blokátory kalciových kanálov sa majú používať len v kombinácii s ACEI alebo ARB, nakoľko samotné môžu zvyšovať albuminúriu v dôsledku hyperfiltrácie. Výnimkou sú pacienti po transplantácii obličky, u ktorých sú liekmi voľby ARB alebo dihydropyridínové blokátory kalciových kanálov (KDIGO 2021). Použitie ostatných antihypertenzív ako aj nefarmakologických opatrení (zníženie príjmu soli < 5 g/deň, redukcia nadváhy, fyzická aktivita a pod) sa riadi všeobecnými zásadami liečby hypertenzie.
5.4 Liečba dyslipoproteinémie
Odporúčania ESC/EAS 2019 pre manažment dyslipidémií, ako aj odporúčania ESC/EASD 2019 zaraďujú diabetikov s CKD (bez ohľadu na typ diabetu) do kategórie veľmi vysokého KV-rizika (riziko u diabetika s CKD je 2 - až 4-krát vyššie ako u diabetika bez nefropatie). Cieľový LDL-cholesterol u týchto pacientov má byť < 1,4 mmol/l. Základom liečby sú statíny, ktoré dokázateľne znižujú KV-riziko u diabetikov s CKD v štádiu 1–4 (pre štádium 5 nie sú dôkazy jednoznačné). Preferuje sa atorvastatín alebo rosuvastatín, ktoré majú predpoklad rýchleho dosiahnutia cieľového LDL-cholesterolu. Výhodná je kombinácia statínu s ezetimibom (v jednej tablete), ktorá znižuje LDL-cholesterol viac ako zdvojnásobenie dávky statínu. Pri vysokej koncentrácii triacylglycerolov (> 5 mmol/l) je možná kombinácia s fibrátom, aj keď u pacientov s CKD nie je všeobecne prijímaná. Možné zvýšenie koncentrácie sérového kreatinínu pri liečbe fibrátmi je dôsledkom interferencie s tubulárnou sekréciou kreatinínu a po prerušení liečby je plne reverzibilné. Hoci sa statíny eliminujú prevažne pečeňou, vzhľadom na zvýšené riziko myopatie /rabdomyolýzy pri CKD a častú polypragmáziu s rizikom liekových interakcií sa u týchto pacientov odporúča úprava dávok statínov podľa GF (tab. 6). Fenofibrát sa eliminuje hlavne obličkami, preto treba dávku tiež prispôsobiť GF. Ezetimib úpravu dávky nevyžaduje. Skúsenosti s inhibítormi PCSK9 u pacientov s CKD sú zatiaľ obmedzené.
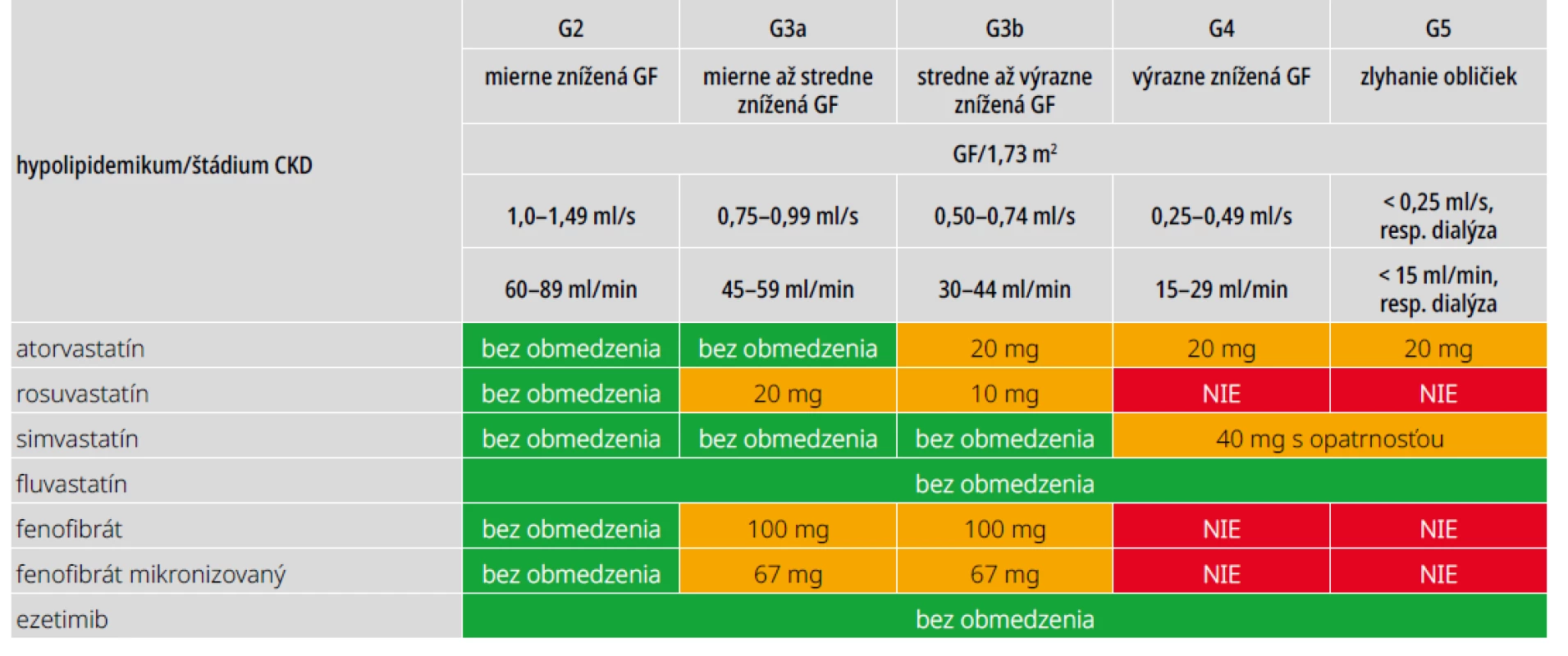
U pacientov na dialýze sa neodporúča liečbu statínmi začať (napriek významnej redukcii LDL-cholesterolu v doterajších štúdiách väčšinou neznížili KV-morbiditu a mortalitu), ale má sa v nej pokračovať, ak ju dostávali už pred začatím dialýzy.
Dyslipoproteinémia môže zvyšovať albuminúriu a urýchliť progresiu nefropatie, ale renoprotektívny účinok statínov v kontrolovaných štúdiách nebol jednoznačný. Viaceré metaanalýzy však potvrdili efekt statínov na zníženie proteinúrie aj spomalenie poklesu GF.
6 Spolupráca nefrológa a diabetológa
Spolupráca nefrológa s diabetológom, prípadne s inými špecialistami je v prevencii a liečbe CKD pri diabete kľúčová. Jej cieľom je odhaliť nefropatiu vo včasnom štádiu a zabrániť jej progresii a vývoju sprievodných extrarenálnych (najmä KV) komplikácií. Vzhľadom na nezanedbateľný podiel nediabetických nefropatií u diabetikov 2. typu, ako aj možnosť atypického priebehu samotnej DN (pozri časť 4.2, s. 8) je včasná diferenciálna diagnostika nefrológom veľmi dôležitá. Od úrovne GF < 1 ml/s/1,73 m2 trvajúcej najmenej 3 mesiace (štádium CKD 3a a vyššie) alebo pri makroalbuminúrii, resp. klinickej proteinúrii > 0,5 g/24 hod by mal byť diabetik dispenzarizovaný aj v nefrologickej ambulancii.
doc. MUDr. Adrián Okša, CSc.
www.nefro.sk
Doručené do redakcie/Received 12. 4. 2021
Zdroje
- KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int 2021; 99(Suppl 3): S1–S87. Dostupné z DOI: <http://doi: 10.1016/j.kint.2020.11.003>.
- KDIGO 2020 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int 2020; 98(Suppl 4): S1–S115. Dostupné z DOI: <http://doi: 10.1016/j.kint.2020.06.019>.
- Ikizler TA, Burrowes JD, Byham-Gray LD, et al; KDOQI Nutrition in CKD Guideline Work Group. KDOQI clinical practice guideline for nutrition in CKD: 2020 update. Am J Kidney Dis 2020; 76(3 Suppl 1): S1-S107. Dostupné z DOI: <http://doi: 10.1053/j.ajkd.2020.05.006>.
- Buse JB, Wexler DJ, Tsapas A et al. 2019 Update to: Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2020; 43(2): 487–493. Dostupné z DOI: <http://doi: 10.2337/dci19–0066>.
- Cosentino F, Grant PJ, Aboyans V et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J 2020; 41(2): 255–323. Dostupné z DOI: <http://doi: 10.1093/eurheartj/ehz486>.
- The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). 2019 ESC/EAS guidelines for the management of dyslipidaemias: Lipid modification to reduce cardiovascular risk. Atherosclerosis 2019; 290 : 140–205. Dostupné z DOI: <http://doi: https://doi.org/10.1016/j.atherosclerosis.2019.08.014>.
- Martinka E, Tkáč I, Mokáň M (eds). Interdisciplinárne štandardy diagnostiky a liečby diabetes mellitus, jeho komplikácií a najvýznamnejších sprievodných ochorení. Forum Diab 2018; 7(2 Suppl 1): 69–73.
- Clinical Practice Guideline on management of patients with diabetes and chronic kidney disease stage 3b or higher (eGFR <45 ml/min). Nephrol Dial Transplant 2015, 30(Suppl 2): ii1–ii142. Dostupné z DOI: <http://doi: 10.1093/ndt/gfv100>.
- Okša A, Ponťuch P, Spustová V et al. Diabetická nefropatia – diagnostika, prevencia a liečba: odporúčané postupy Slovenskej nefrologickej spoločnosti a Slovenskej diabetologickej spoločnosti. Diab Obez 2012; 12(24): 99–107.
- KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int, Suppl 2013; 3 : 1–150. Dostupné z WWW: http:// <https://kdigo.org/wp-content/uploads/2017/02/KDIGO_2012_CKD_GL.pdf>.
Štítky
Diabetologie ObezitologieČlánek vyšel v časopise
Diabetes a obezita

2021 Číslo Supplementum
Nejčtenější v tomto čísle
